编辑点评:
化学溶液的形成ppt课件是一套关于溶液的形成的知识点ppt课件,由27张化学溶液知识的幻灯片图表组成,内容上有实验思考,活动与探究,随堂练习等相关模块,用户也可以根据需求增减内容。
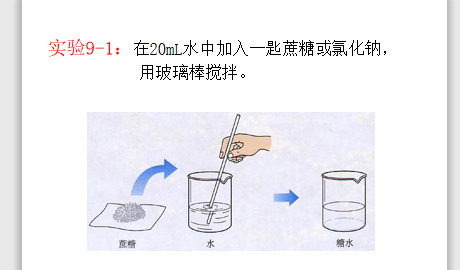
化学溶液的形成ppt课件预览图




溶液的性质
1.均一性:溶液各处的密度、组成和性质完全一样;
2.稳定性:温度不变,溶剂量不变时,溶质和溶剂长期不会分离(透明);
3混合物:溶液一定是混合物。
溶液的类别
饱和溶液:在一定温度、一定量的溶剂中,溶质不能继续被溶解的溶液。
不饱和溶液:在一定温度、一定量的溶剂中,溶质可以继续被溶解的溶液。
饱和与不饱和溶液的互相转化:
不饱和溶液通过增加溶质(对一切溶液适用)或降低温度(对于大多数溶解度随温度升高而升高的溶质适用,反之则须升高温度,如石灰水)、蒸发溶剂(溶剂是液体时)能转化为饱和溶液。
饱和溶液通过增加溶剂(对一切溶液适用)或升高温度(对于大多数溶解度随温度升高而升高的溶质适用,反之则降低温度,如石灰水)能转化为不饱和溶液。
规则溶液是更接近实际溶液的一种溶液。它的形成除混合熵不等于零外,其他特性和理想溶液一致。由规则溶液推导出的热力学规律,广泛应用于非电解质溶液,尤其对许多合金溶液的应用,更为合适。因此,对于冶金和金属材料科学来说,规则溶液理论是十分重要的。
使溶液变浓的方法
1.增加溶质
令溶液质量为m g,溶质的质量分数为a%
若使其质量分数增大一倍
则要加am/100+2a g 的溶质
2.蒸发溶剂
令溶液质量为m g,则蒸发m/2 g溶剂
3.用浓溶液混合
令稀释前溶液质量为m g,溶质的质量分数为a%;稀释后溶液质量为n g,溶质的质量分数为b%
则有m g*a%+n g*b%/m g+n g*100%=b%


 创意手绘工作总结PPT模板
创意手绘工作总结PPT模板 可爱卡通班干部竞选ppt模板
可爱卡通班干部竞选ppt模板 2020述职报告ppt模板免费版
2020述职报告ppt模板免费版 项目策划ppt模板
项目策划ppt模板 梦幻风格动态ppt模板79套
梦幻风格动态ppt模板79套 森系小清新ppt通用模板
森系小清新ppt通用模板 办公背景财务报表ppt模板
办公背景财务报表ppt模板 水墨山水画背景ppt模板
水墨山水画背景ppt模板 喜庆传统节日冬至ppt下载
喜庆传统节日冬至ppt下载 黑金风格企业年会邀请函ppt模板
黑金风格企业年会邀请函ppt模板









 BIM技术应用成果汇报ppt免费版
BIM技术应用成果汇报ppt免费版 后勤管理工作总结汇报PPT模板2020最新版
后勤管理工作总结汇报PPT模板2020最新版 灰红商务个人述职报告ppt模板
灰红商务个人述职报告ppt模板 红色喜庆2020年春节ppt模板
红色喜庆2020年春节ppt模板 篮球比赛活动策划方案ppt模板
篮球比赛活动策划方案ppt模板 果蔬背景农产品介绍ppt
果蔬背景农产品介绍ppt 企业微营销实战攻略ppt模板
企业微营销实战攻略ppt模板 互联网时代的商业模式免费ppt模板
互联网时代的商业模式免费ppt模板 23个提高记忆力的方法ppt
23个提高记忆力的方法ppt 九年级上册数学二次函数ppt
九年级上册数学二次函数ppt 应用一元二次方程ppt课件
应用一元二次方程ppt课件 燃料的合理利用与开发ppt课件
燃料的合理利用与开发ppt课件 燃烧的条件ppt沪教版
燃烧的条件ppt沪教版 瑜伽培训ppt模板免费
瑜伽培训ppt模板免费 古典风荷花背景ppt通用模板
古典风荷花背景ppt通用模板 大小: 2.8M
大小: 2.8M











 企业产品宣传广告模板ppt
企业产品宣传广告模板ppt
 清新风年会颁奖典礼活动ppt模板
清新风年会颁奖典礼活动ppt模板
 唯美牵手简约ppt模板
唯美牵手简约ppt模板
 剪纸风年度工作总结ppt案例
剪纸风年度工作总结ppt案例
 简约大气年终工作总结ppt
简约大气年终工作总结ppt
热门评论
最新评论